|
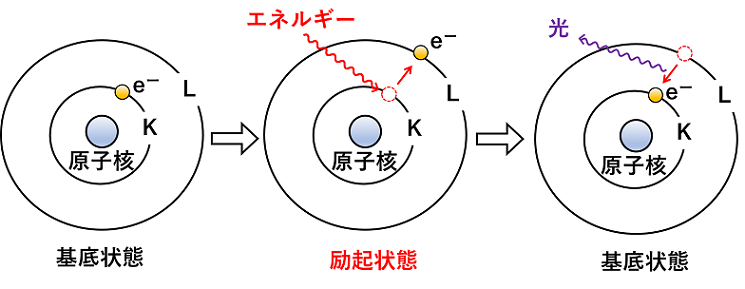
【発展】電子軌道(原子軌道) 水素のスペクトルと電子殻 水素原子がエネルギーを得ると,K殻(基底状態)にある電子がエネルギーを得て,エネルギー状態の高いL殻など(励起状態)に移動する。その後,もとのK殻に電子が戻るときL殻などとK殻のエネルギー差に相当するエネルギーの光を発する。 |
||
 |
||
|
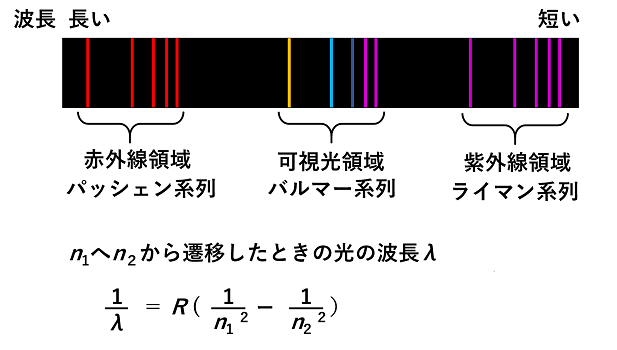
そこで,水素を放電管に入れ電圧をかけ,出てきた光を分光器(プリズムや回折格子によって光を波長毎に分けて波長毎の光強度を測定する装置)に通すと,光が波長の違い(色の違い)によって分かれて線状のスペクトル(複雑な組成をもつものを成分に分解し,それらを特徴づける量の大小の順に並べたもの。ここでは光や電磁波を分光装置によって波長の違いに従って分解し,波長の順に並べたもの)が観測される(左下図)。 |
||
|
||
|
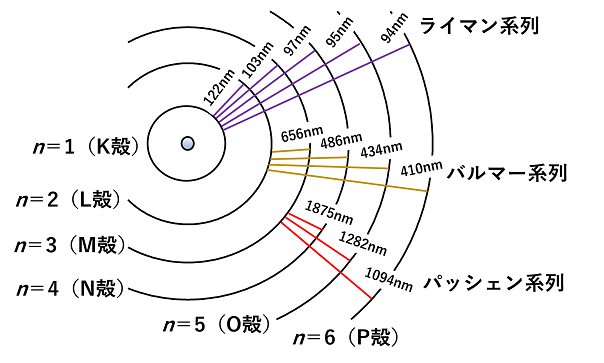
水素原子からの発光の波長は数箇所に集まっている。紫外領域のスペクトルをライマン系列,可視~紫外領域のスペクトルをバルマー系列赤外領域のスペクトルをパッシェン系列とよぶ。 スペクトルの波長は,各電子殻の電子の持つエネルギー差から求められる。n1へn2から遷移したときの光の波長は上の式(Rはリュードベリ定数)より求められる。 K殻,L殻,M殻,…をn=1,2,3,…とすると,ライマン系列はn=1(基底状態)にそれよりもエネルギーの高い電子殻から電子が遷移したことにより放出された光に由来する輝線である。また,バルマー系列はn=2への遷移によって放出される光,パッシェン系列はn=3への遷移によって放出される光に由来する輝線である(右上図)。 スペクトルの測定により,原子には電子殻があり,電子は電子殻の中を運動していることが分かる。 |
||
|
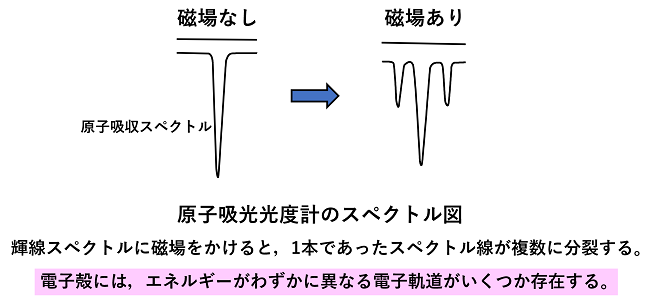
電子軌道(原子軌道) 原子の輝線スペクトルは,磁場をかけるといくつかの線に分裂する。磁場がない場合は縮退(2つ以上の異なった状態が同じエネルギー順位に存在すること)している軌道エネルギー(左)が,磁場がかかることで分裂する(右)。この現象をゼーマン効果という。また,原子を電場中に置いた場合のスペクトル線の分裂はシュタルク効果という。 このことから,電子殻中の電子にはいくつかの異なる運動状態が存在することが分かる。 シュレーディンガーは電子殻中の電子の運動状態を方程式で表した。この方程式は電子のエネルギーと波動の関数で,この方程式を解くことによって,電子殻のエネルギー準位(エネルギーの値)が求まり,電子軌道の形,電子軌道の方向を判断する指標が得られた。 |
||
|
||
|
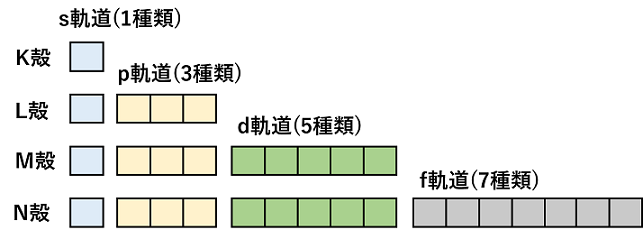
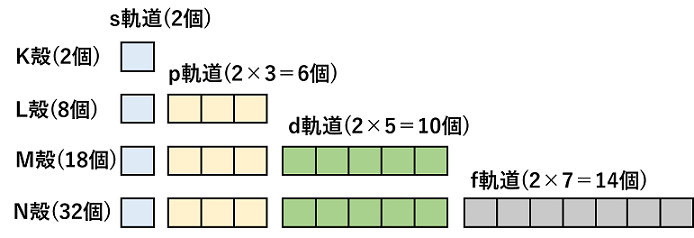
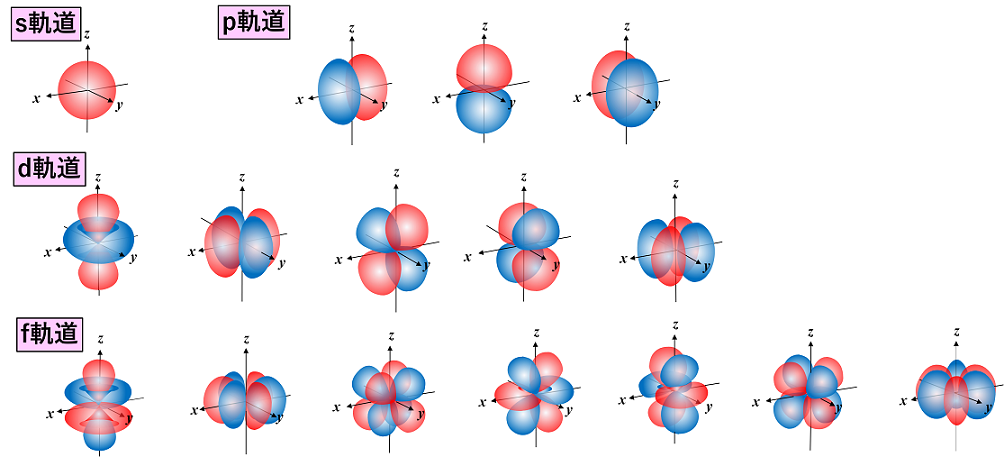
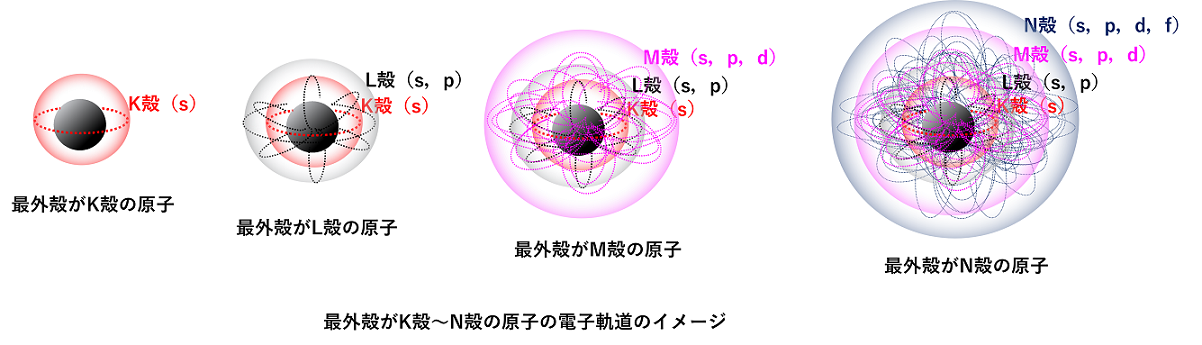
シュレーディンガー方程式より,電子殻中の電子は,そのエネルギー準位によって決まった運動をしていることが考えられる。これは,電子が軌道上を運動していると考えるとよい。これを電子軌道(または原子軌道)という。電子軌道には,その形によって,s軌道,p軌道,d軌道,f軌道,…がある。さらに各軌道は,その方向(x,y,z軸方向)性によって,s軌道は1種,p軌道は3種,d軌道は5種,f軌道は7種が考えられる。 |
||
 |
||
|
||
 |
||
|
||
|
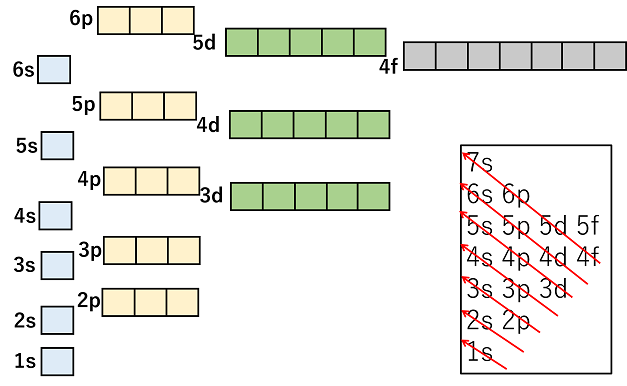
電子軌道のエネルギー順位と電子配置 電子はエネルギー準位の低い軌道から順に入っていく。一般的な電子軌道のエネルギー準位を図示すると下のようになる。 |
||
|
||
|
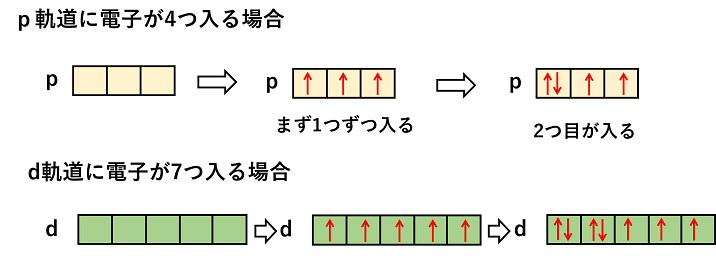
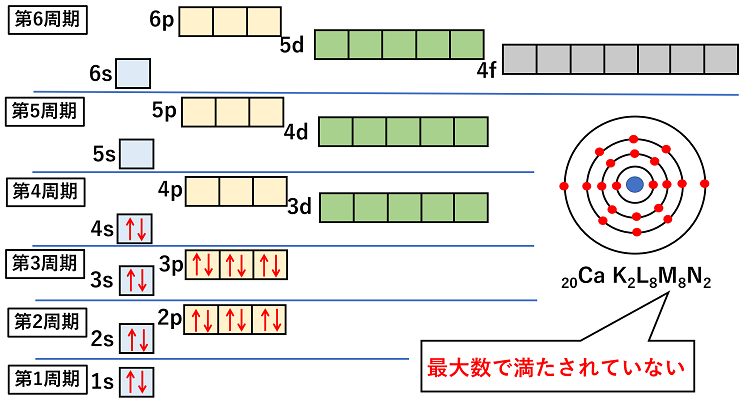
エネルギー準位は,原則的に内側の電子殻の方が低いが,d軌道やf軌道は必ずしも内側が低いわけではない。例えば,N殻のs軌道(4s軌道)とM殻のd軌道(3d軌道)では,より外側にあるN殻のs軌道(4s軌道)のエネルギー準位の方が低くなっている。 電子は,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5fといった具合に入っていく。 また,p,d,f軌道は方向性によってエネルギー準位の等しい複数の軌道ができる。この場合,電子はまず1つずつ入っていき,さらに2つ目がスピンを逆にして入っていく。下の図では,スピンの向きを考慮して,電子を→で示している。 |
||
 |
||
|
20Caの電子配置を考えてみると次のようになる。 |
||
 |
||
 |